- dossierInflammation chronique : symptômes, causes et traitement
- dossierSymptômes d’une infection à Pseudomonas : poumons, voies urinaires, yeux…
- dossierSyndrome métabolique : une combinaison de problèmes métaboliques
- dossierPaludisme : quels sont les symptômes de la malaria et comment se protéger ?
- dossierMycose des pieds : des champignons entre les orteils qui se propagent au pied
Pourquoi est-il si difficile de créer un vaccin ?
dossier L’Organisation mondiale de la santé (OMS) estime que la vaccination prévient à elle seule chaque année environ 3 millions de décès dans le monde. C’est, avec l’accès à l’eau potable, la mesure de santé publique qui a le plus grand impact en termes de réduction de la mortalité.
Pour faire face à la pandémie de Covid-19 causée par le coronavirus émergent SARS-CoV-2, deux pistes principales ont été explorées : celle des traitements antiviraux, et celle des vaccins. Alors que l’essai clinique Solidarity, monté par l’OMS pour aider à trouver un traitement efficace contre la Covid-19, n’a pas abouti, trois vaccins contre le SARS-CoV-2 ont été développés durant l’année 2020 : BNT162b2 (BioNTech/Pfizer), mRNA-1273 (Moderna), ChAdOx1 nCoV-19 (Oxford/AstraZeneca).
En quelques mois, ils ont pu être testés chez l’animal et validés par des essais cliniques chez l’être humain, ce qui constitue un record absolu dans l’histoire de la vaccination moderne. Auparavant, on considérait qu’il fallait en moyenne 8 ans pour disposer d’un vaccin efficace et sûr.
Comment s’explique ce succès ? Annonce-t-il une nouvelle révolution vaccinale, qui permettrait de développer des vaccins contre n’importe quel agent pathogène ? La réalité est plus nuancée.
Vaccins Covid-19 : la recette d’un succès
Vaccin atténué, inactivé, sous-unitaire adjuvanté, vecteur viral, ARN… Face à l’urgence sanitaire due à la propagation rapide du SARS-CoV-2, toutes les technologies vaccinales disponibles ont été utilisées sans a priori pour tenter de mettre au point un vaccin, l’objectif étant de réduire le risque d’échec. Toutes les étapes de développement et de validation se sont également enchaînées, sans la moindre pause.
Cette stratégie du « tout en même temps », financièrement très coûteuse et risquée, n’a été possible que grâce à un investissement massif de la part des États. Le gouvernement américain a investi jusqu’à ce jour, via l’Operation Warp Speed, plus de 18 milliards de dollars pour financer le développement des vaccins contre la Covid-19. Un chiffre impressionnant, mais qui reste négligeable face au coût estimé de l’épidémie de Covid-19 pour ce pays. Dans l’hypothèse où elle serait maîtrisée fin 2021, les experts estiment elle aura alors coûté aux États-Unis entre 3 000 et 16 000 milliards de dollars.
Cet investissement massif ne sera pas uniquement profitable à la gestion de la pandémie de SARS-CoV-2. Il a notamment permis de valider l’usage chez l’humain de la technologie des vaccins à ARN, qui dispose de plusieurs avantages majeurs. Cette technologie permet en effet de développer directement un vaccin à partir de la séquence génétique de l’agent pathogène, sans passer par sa culture ou la production par génie génétique de ses protéines, ce qui représente un gain de temps considérable.
Chez la souris, cette technologie a rendu possible le développement en quelques mois de vaccins protecteurs contre des virus tels que le virus Influenza H1N1 ou le virus Ebola. Elle permet d’envisager de produire des candidats vaccins pour faire face localement à des agents infectieux émergents avant qu’ils ne se propagent et ne constituent un risque de pandémie.
Enfin, elle ouvre également la voie à des vaccins personnalisés contre les tumeurs ou les maladies autoimmunes. Ces vaccins thérapeutiques, produits spécifiquement pour un seul individu, révolutionneraient l’immunothérapie.
Des succès, mais aussi de nombreux échecs
Cette réussite et ces espoirs ne doivent cependant pas nous faire oublier qu’il existe plus de 1400 agents pathogènes infectant l’humain et qu’il en émerge de nouveaux chaque année. Plus d’un siècle s’est écoulé depuis la découverte de la vaccination par Louis Pasteur, mais dans ce laps de temps, nous n’avons été capables de produire des vaccins efficaces que contre moins d’une trentaine de maladies infectieuses.
Bien sûr, nous n’avons pas besoin de vaccins contre tous les pathogènes. Beaucoup ne causent que des pathologies bénignes et de nombreuses infections sont évitables par des mesures prophylactiques simples. Néanmoins, nous essuyons des échecs répétés depuis des décennies face à plusieurs pathogènes représentant des priorités de santé publique.
Les causes de ces échecs sont multiples. L’une d’entre elles repose sur le modèle de financement des vaccins. Complexe et laborieux, il implique souvent de nombreux partenariats public-privé. Or, le marché potentiel pour certains vaccins peut être jugé insuffisant par les investisseurs privés. Par exemple, quand le pathogène n’infecte qu’un nombre réduit d’individus ou présente une distribution géographique limitée.
Mais l’argent ne fait pas tout : des investissements considérables ont été réalisés pour lutter contre le virus de l’immunodéficience humaine (VIH) responsable du Sida, la bactérie Mycobacterium tuberculosis (aussi connue sous l’appellation « bacille de Koch »), responsable de la tuberculose ou les parasites protozoaires Plasmodium (cause du paludisme, ou malaria), responsable à eux trois de plus de 2,5 millions de morts par an. Ces investissements n’ont pourtant toujours pas permis le développement de vaccins présentant une efficacité satisfaisante. Premier espoir, un vaccin contre le paludisme, le vaccin RTS,S/AS01 (Mosquirix, GSK), a montré une protection significative mais partielle chez les jeunes enfants en 2015.
Pourquoi de telles difficultés, même lorsque les moyens alloués à la recherche de nouveaux vaccins sont considérables ? Les nouvelles technologies vaccinales, comme les vaccins ARN, pourront-elles changer cette situation ?
Les obstacles techniques au développement des vaccins
Suite à la détection d’un agent pathogène, le système immunitaire riposte rapidement par une réponse innée, médiée notamment par les cellules des muqueuses et les macrophages. Pour infecter l’hôte, un pathogène doit être capable, à minima, d’échapper partiellement à cette réponse stéréotypée, qui n’est pas spécifique d’un envahisseur donné. Le développement d’une réponse adaptative, spécifique du pathogène et médiée par les lymphocytes, permet le plus souvent au système immunitaire d’éliminer l’agent infectieux et d’acquérir une immunité de longue durée contre celui-ci.
Le principe de la vaccination est de copier cette immunité adaptative, qui se développe suite à une infection naturelle. Tous les vaccins contiennent donc des informations sur la structure de l’agent pathogène, ce que l’on nomme les « antigènes » (terme désignant tout élément étranger à l’organisme capable de déclencher une réponse immunitaire). Selon le type de vaccin, les antigènes peuvent être présents sous la forme, par exemple, de protéines du virus (vaccin sous-unitaire adjuvanté) ou de matériel génétique (vaccin vectorisé, vaccin ARN) viral. Ils sont indispensables pour induire le développement des populations lymphocytaires spécifiques de mémoire qui vont permettre de contrôler et d’éliminer le pathogène.
Lorsque l’on souhaite développer un vaccin contre un agent pathogène, l’identification des antigènes vaccinaux est donc considérée comme un pré-requis. Le génome de la majorité des virus ne comprend que quelques dizaines, voir quelques centaines de gènes. Il est donc assez aisé d’identifier ceux correspondant aux antigènes les plus exposés au système immunitaire, comme la protéine « spike » du SARS-CoV-2.
Chez les bactéries et les protozoaires, les choses sont différentes : leur génome comporte plusieurs milliers de gènes. Et celui de certains vers parasites des dizaines de milliers. Par conséquent, identifier les antigènes vaccinaux pour ces pathogènes hautement complexes peut nécessiter un travail de très longue haleine.
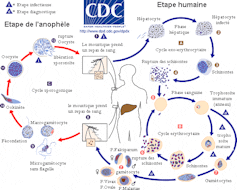
De plus, certains pathogènes présentent des cycles de vie complexes au sein de leur hôte (l’organisme qu’ils infectent). Ils peuvent se transformer en cours d’infection. Ces modifications peuvent s’accompagner de l’expression d’antigènes différents à chaque étape du cycle. Cela complique encore l’identification des antigènes les plus appropriés pour mettre au point un vaccin efficace. C’est par exemple le cas des protozoaires Plasmodium, agents du paludisme, dont une partie du cycle de vie se déroule chez le moustique anophèle et l’autre chez l’être humain. Le moustique vecteur infecte l’humain avec une première forme du parasite, laquelle va se multiplier dans les cellules du foie et se transformer en une seconde forme. Celle-ci va infecter les globules rouges et s’y multiplier sous une troisième forme. Chacune de ces forme présente des antigènes distincts.
Le problème de l’échappement à la réponse immunitaire
Au-delà de ces difficultés à identifier les antigènes vaccinaux, de nombreux agents pathogènes ont également acquis au cours de l’évolution des mécanismes d’échappement à la réponse immunitaire adaptative. Ces mécanismes leur permettent de persister dans l’hôte durant de longues périodes, parfois durant toute la vie de celui-ci, ce qui augmente leurs chances de transmission. Ce sont ces mécanismes d’échappement, qui reposent principalement sur la variation antigénique (les antigènes se modifient au fil du temps, ce qui contrecarre le développement d’une immunité adaptative), la furtivité ou la neutralisation du système immunitaire, qui rendent parfois cauchemardesque le développement d’un vaccin.
Le génome des virus à ARN évolue à une vitesse extrêmement rapide. En effet, lorsque ces virus se multiplient et recopient leur matériel génétique, ils commettent de nombreuses erreurs, ce qui mène à l’émergence d’une large population de variants. Cette grande diversité peut rendre impossible l’identification d’antigènes vaccinaux qui permettraient de cibler l’ensemble de la population.
Le cas du virus influenza responsable de la grippe est à ce titre emblématique. Son génome peut évoluer graduellement non seulement par mutations (on appelle ce phénomène « dérive antigénique »), mais également par l’échange de gènes entiers avec d’autres virus de la même espèce (réassortiment). Les vaccins contre la grippe ne peuvent cibler tous ces antigènes ; ils ne contiennent que les plus courants. De ce fait, ils ne protègent pas contre tous les variants du virus et leur composition doit être actualisée chaque année pour tenir compte des antigènes présents sur les virus majoritairement en circulation.
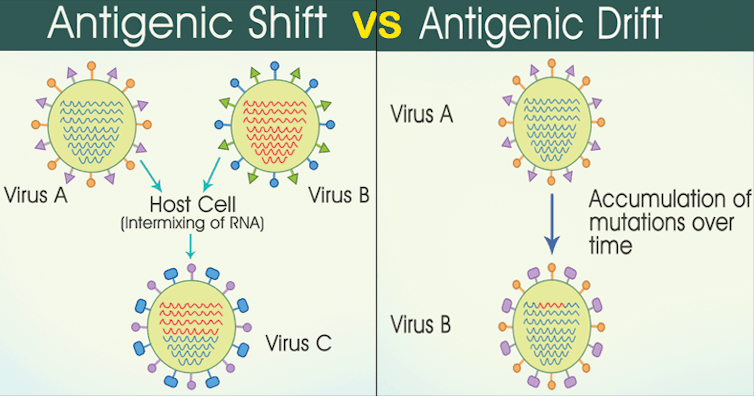
Certains pathogènes sont même capables de varier les antigènes les plus exposés à leur surface à une vitesse telle qu’ils génèrent une importante population de variants au sein même de l’hôte infecté. C’est par exemple le cas de la bactérie Helicobacter pylori, qui provoque des ulcères gastro-duodénaux, ou du protozoaireTrypanosoma brucei, l’agent de la maladie du sommeil. Cette variabilité permanente empêche le système immunitaire adaptatif de cibler l’ensemble de la population des envahisseurs, et donc de les neutraliser.
D’autres pathogènes peuvent se rendre quasiment invisibles pour le système immunitaire en neutralisant directement ses voies d’activation ou en modifiant les cellules de l’hôte pour se construire des réservoirs cellulaires les isolant de la réponse immunitaire. Les virus de la famille Herpesviridae, comme le cytomégalovirus, bloquent la présentation de leurs antigènes au système immunitaire. La bactérie Mycobacterium tuberculosis perturbe les mécanismes microbicides et modifie à son avantage le métabolisme des macrophages qu’elle infecte.
La suppression partielle ou totale du système immunitaire, qui se traduit par un affaiblissement du système immunitaire de l’hôte (immunodépression), constitue une autre stratégie efficace assurant la persistance de l’agent pathogène. Elle est susceptible d’invalider l’ensemble des stratégies vaccinales. Le virus de la rougeole réduit la diversité du répertoire des anticorps de son hôte et abolit la mémoire immunitaire protectrice acquise contre d’autres pathogènes, provoquant une « amnésie immunitaire ». L’infection par les protozoaires Plasmodium induit quant à elle la production d’immunosuppresseurs, des molécules qui affectent l’ensemble du système immunitaire et réduisent durablement la capacité de l’hôte à réagir aux infections et à développer une immunité suite à une vaccination.
Et rien n’interdit à certains pathogènes de cumuler de nombreux mécanismes d’échappement. Le VIH, par exemple, présente un taux de mutation très élevé source de nombreux variants, est capable de s’intégrer pour une longue durée au génome des cellules de son hôte, ce qui le rend indétectable, et détruit les lymphocytes T CD4, ce qui cause à terme une immunodépression profonde et irréversible. Cette combinaison de mécanismes d’échappement défie jusqu’à présent toutes les stratégies vaccinales.
Le succès des vaccins Covid-19 ne doit pas nous aveugler
Certes, les techniques de vaccination ont considérablement progressé ces dernières décennies, grâce notamment à une meilleure compréhension du système immunitaire et aux progrès des techniques de biologie moléculaire. Malgré tout, il faut souligner que nous avons eu la « chance » d’être confronté, avec le coronavirus SARS-CoV-2, à un agent pathogène relativement « simple ».
En effet, si les nouvelles plates-formes vaccinales permettent de produire rapidement des vaccins à partir de la séquence génétique d’un agent pathogène, il est peu probable que cette approche empirique suffise à faire face à des micro-organismes complexes, ou disposant de mécanismes d’échappement à la réponse immunitaire adaptative.
Pour contrer des pathogènes de ce type, il restera sans doute nécessaire de caractériser finement leur cycle de multiplication ainsi que leurs interactions avec le système immunitaire de l’hôte, pour révéler le défaut de leur cuirasse.
Ce qui peut s’avérer laborieux et implique le financement d’une recherche fondamentale sans a priori sur le très long terme, ainsi qu’une coopération étroite entre immunologistes et microbiologistes.
Il faut également garder à l’esprit que disposer d’un vaccin efficace ne dispense pas de surveiller l’évolution génomique du pathogène concerné. En effet, la relation entre un pathogène et son hôte suit une dynamique de type Reine Rouge : les pathogènes évoluent sans cesse en réponse aux pressions de sélection de leur hôte, comme le montrent l’acquisition de résistances aux antibiotiques, aux antiviraux et à certains vaccins.
De nombreuses mutations du SARS-CoV-2 ont déjà été documentées. La pression de sélection engendrée par les vaccins Covid-19 sélectionnera-t-elle des variants capables d’échapper à ceux-ci ? L’avenir nous le dira. Une chose est sûre, surveiller et comprendre les interactions entre le pathogène et son hôte est important pour anticiper ces problèmes potentiels.
Enfin, un vaccin n’est efficace que si l’on s’en sert. Or, vacciner la population mondiale est un défi, non seulement logistique, en raison de la médiocrité des infrastructures dans de nombreuses régions, mais aussi parce que le niveau d’hésitation vaccinale est élevé. Au point que l’hésitation vaccinale a été identifiée par l’OMS en 2019 comme l’une des 10 principales menaces sur la santé mondiale.
En conclusion, il reste donc impératif d’investir massivement dans les systèmes de santé, la communication scientifique et surtout, dans la prévention des pandémies, en agissant sur les conditions socio-économiques favorisant leur émergence. Car il est maintenant évident que prévenir ces crises coûte bien moins cher que de les subir.![]()
► Eric Muraille, biologiste, immunologiste, maître de recherches au FNRS, Université Libre de Bruxelles (ULB).
► Cet article est republié à partir de The Conversation sous licence Creative Commons.